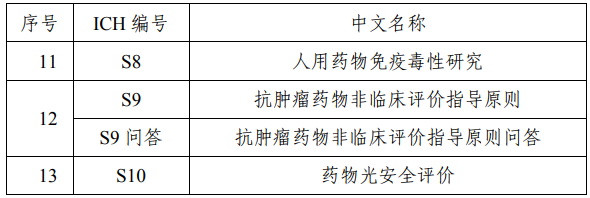
國家藥監局關于適用《S1A:藥物致癌性試驗必要性指導原則》等13個國際人用藥品注冊技術協調會指導原則的公告
來源: 作者: 時間:2019-11-13 閱讀:
國家藥監局關于適用《S1A:藥物致癌性試驗必要性指導原則》等13個國際人用藥品注冊技術協調會指導原則的公告
(2019年第89號)
為推動藥品注冊技術標準與國際接軌,經研究,國家藥品監督管理局決定適用《S1A:藥物致癌性試驗必要性指導原則》等13個國際人用藥品注冊技術協調會(ICH)指導原則(詳見附件)。現就有關事項公告如下。
一、申請人需在現行技術要求基礎上盡早按照ICH指導原則開展研究;自2020年5月1日起開始的非臨床研究適用13個ICH非臨床指導原則,非臨床研究起始日期的認定遵照《藥物非臨床研究質量管理規范》中相關規定執行。
二、相關技術指導原則可在國家藥品監督管理局藥品審評中心網站查詢。國家藥品監督管理局藥品審評中心負責做好本公告實施過程中的相關技術指導工作。
特此公告。
國家藥監局
2019年11月5日

上篇:
下篇:




 甘公網安備 62010002000454號
甘公網安備 62010002000454號